Aula 9 - Fermentação Ácido cítrico
Aula 9 - Fermentação Ácido cítrico
[editar | editar código-fonte]Objetivo Geral:
[editar | editar código-fonte]Apresentar o bioprocesso de fermentação de Ácido cítrico.
Objetivos específicos:
[editar | editar código-fonte]- explicar os tipos de bioprocessos e suas características empregados na produção de Ácido cítrico
- apresentar algumas característica exclusivas do bioprocesso abordado
Exercícios Bônus
[editar | editar código-fonte]Formulário com exercício Bônus
Introdução a fermentação do Ácido cítrico
[editar | editar código-fonte]O ácido cítrico, também conhecido como citrato de hidrogênio de nome oficial ácido 2-hidroxi-1,2,3- propanotricarboxílico, é um ácido orgânico fraco, que se pode encontrar nos citrinos. É o ácido mais utilizado pela indústria alimentícia e de bebidas devido suas propriedades, entre as principais por não apresentar sabor desagradável, ser antioxidante, bom agente tamponante, acidulante, controle de crescimento microbiano, flavorizante, sequestrante, alta solubilidade e regulador de acidez além de sua baixa toxicidade e baixo custo, quando comparado a outros acidulantes utilizados pelas indústrias farmacêuticas e de alimentos.
Pode ser usado em diversos tipos de produtos, em indústria de alimentos como refrescos, geléias (auxílio na formação do gel), pós para sobremesas de gelatinas, flans, pudins e similares até de cosméticos como xampus, sabonetes líquidos, cremes e loções.
Esse produto é utilizado também pela sua capacidade de complexação com metais pesados (ferro e cobre), utilizamos esse atributo como estabilizante de óleos e gorduras reduzindo a oxidação catalisada por esses metais. Podemos utilizar para detergência de uso doméstico e não só para limpeza de metais, isso acontece com a substituição do fosfato pelo ácido cítrico, para aumentar sua potência, é muito utilizado por ser facilmente degradado.
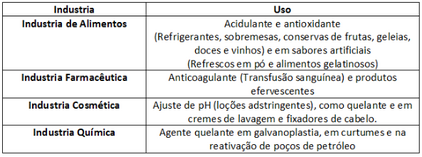
Esse ácido é isolado de frutas cítricas e obtido pelo processo de fermentação de sacarose realizada pelo fungo Aspergillus niger ou pela levedura Candida lipolytica, utilizando como matéria prima o melaço de cana de açúcar ou a dextrose. Tal processo dá origem ao ácido cítrico líquido, que, posteriormente, é purificado, assumindo a forma sólida. Seu teor de acidez se deve à presença das 3 carboxilas (COOH) na cadeia carbônica, sendo classificado, portanto, como um ácido tricarboxílico. O ácido cítrico é usado com diversas funções, em diferentes indústrias, como mostra a tabela 1.0

Breve histórico
[editar | editar código-fonte]O ácido cítrico foi descoberto no oitavo século depois de cristo, pelo alquimista islâmico Abu Musa Jabir ibn Hayyan.
Em 1784 foi o primeiro ácido isolado, pelo químico sueco Carl Wilhelm Scheele, onde a partir do suco de limão cristalizou o ácido. Foi produzido para comercialização na Inglaterra em 1826, a partir do citrato de calcio italiano do suco de limão.
Em 1880, ácido cítrico começou a ser sintetizado a partir de glicerol, posteriormente a partir da dicloroacetona. Outras técnicas foram utilizadas, porém limitações técnicas e econômicas comprovaram a inviabilidade desses processos.
Posteriormente em 1893, alguns cientistas descobriram que as espécies fúngicas de Citromyces (hoje em dia nomeada como Penicillium) acumulavam ácido cítrico no meio que continha açúcar e sais orgânicos. Devido a problemas de contaminação e longo período de fermentação, a indústria não teve êxito ao utilizar esse processo.
No ano de 1916, verificou-se que algumas linhagens de Aspergillus Níger liberam quantidades significativas de ácido cítrico em meio de alta concentração de açúcar, sais minerais e PH de 2,5 á 3,5. Com esse processo indústria obteve um grande avanço.
Atualmente utilizamos por meio de fermentação a síntese de ácido cítrico. Principalmente o processo submerso, a partir de melaços de cana-de-açúcar e de beterraba, empregando o fungo filamentoso Aspergillus niger. Esse processo é responsável por mais de 90% da produção, por ser mais econômico e simples que a via química.
Figura 1.0 - Linha do tempo referente ao histórico da produção de ácido cítrico.
Tipos de fermentação do ácido cítrico
[editar | editar código-fonte]Em um estudo realizado por Soares Costa e colaboradores (2014), foi avaliado o uso de 12 diferentes CEPAS de A. niger (00098, 00100, 00102, 00104, 00106, 00107, 00108, 00114, 00116, 00118, 00119 e 00124) para a produção de ácido cítrico, vendo as condições de pH do meio e a quantidade de ácido cítrico produzida no meio, sendo a CEPA 00118 que obteve o melhor desempenho, sem nenhum fator do meio alterar o metabolismo ou produção dos fungos (efeitos de metais, aeração, quantidade de açúcar, transferência de calor e oxigênio, foram controladas), podendo este ser utilizado em escalas maiores de produção em biorreatores de fermentação.
- Processo de Koji: substrato sólido, utilizando linhagem específica de A. niger. Primeiramente foi utilizado farelo de trigo, sendo substituído por amido de batata doce.
Cuidados a serem tomados:
· Antes da esterilização, deve-se ajustar o pH do farelo em torno de 4 e 5

· A concentração final de água no farelo após a esterilização deve ser de 70-80%
· A temperatura de inoculação com Koji (preparação prévia contendo amilases e proteases) é de 30-36ºC
· A CEPA ideal de A. niger não está tão susceptível a presença de íons de ferro como as demais
· A temperatura de fermentação não deve exceder os 28ºC
· Pode ser adicionado 3-7% de massa filtrada da fermentação de ácido glutâmico para aumentar a produção.
Processo de superfície: Foi o primeiro a fornecer ácido cítrico a baixo preço, ainda sendo utilizado por muitos fabricantes.
[editar | editar código-fonte]Cuidados a serem tomados:
· Os esporos germinam dentro de 24 horas e o micélio cobre o mosto;
· Na substituição do mosto deve-se tomar os cuidados necessários para que o micélio continue flutuando sobre a superfície (se ele for submerso, torna-se inativo);
· Tempo inicial de crescimento: 3 dias;
· pH para produção: 5-6 na fase inicial, caindo para 1,5 a 2 na fase de germinação de esporo, devido a remoção de íons amônio do meio;
· A produção nesse processo é de 80-85% da massa de carboidratos inicial.
As fontes de carbono são: sacarose e melaço de cana e beterraba (economicamente vantajoso, embora a produção seja ligeiramente menor).
[editar | editar código-fonte]
- Processo Submerso: é o mais difundido por utilizar menos espaço e possibilitar o controle das variáveis durante o período inicial, garantindo sucesso da fermentação e alta velocidade de produção. Qualquer reator de tanque pode ser utilizado e devido ao baixo pH durante a fermentação, deve ser constituído de materiais resistentes.
Tem vantagem sobre o de superfície, em termos de custos de investimento e operação que induziram pesquisadores a procurar desenvolvê-lo para obtenção do ácido cítrico.
AMELUNG, em 1930: Utilizou Aspergillus niger japonicus, onde borbulhou brandamente uma corrente de ar em um meio de cultura de 15 cm de profundidade, obtendo crescimento do micélio submerso e detectando a presença de ácido cítrico no meio, porém em quantidades inferiores à produção observada na fermentação por superfície.
KLUYER e PERQUIN, em 1933: Descreveram os experimentos que fizeram com um meio sendo agitado.
PERQUIN, em 1938: Aplicou na fermentação submersa a ideia de Molliard de deficiência de fosfato (nenhum dos dois reconheceu a influência da presença de traços de íons metabólicos no rendimento da fermentação).
Molliard-Perquin, SCUIZS, em 1944: Obteve uma patente para a fermentação de cultura submersa por crescimento de A. niger em meio rico em fosfato, posteriormente transferindo para um meio sem fosfato ou pelo método de crescimento do micélio em um meio onde inicialmente não havia quantidade suficiente de fosfato, supondo que o crescimento do micélio poderia remover todo o fosfato do meio.
MOYER, em 1953: Descobriu que a adição de metanol nos meios de cultura aumentava a produção de ácido cítrico.
Porém, nem mesmo a aplicação do conceito Molliard-Perquin era um processo comercialmente viável, não foi conseguido demonstrar relação entre a quantidade de fosfato presente no meio e o rendimento do processo.
SHU e JOHNSON, em 1947/48: Demonstraram que íons de ferro e manganês, reduziam ou anulavam a produção de ácido cítrico, contudo, aumentava o crescimento de A. niger.
WOODWAD et al, 1949: Realizou a remoção de íons metálicos não desejáveis por troca iônica.
SCHWVEIGER, 1957: Realizou o uso de íon cobre como antagonista do ferro e tornou possível o uso comercial do processo.
Procedimento:
O meio de cultura é esterilizado por meio rápido ou ultra rápido, por passagem com fluxo turbulento através de tubos de trocadores de calor com camisas de vapor, sendo resfriado imediatamente a 30ºC em outro trocador de calor.
O inóculo usado são esporos de uma cepa adequada de A. niger, crescida em meio enriquecido sólido, com concentração de íons cobre para neutralizar o ferro de 0,1-50 mg/L, KH2SO4 de 0,01-0,03%, podendo chegar a 2% e sulfato de magnésio heptahidratado a 0,25%. O pH deve ser ajustado antes da inoculação, pela adição de íon amônio para aproximadamente 4,0, sendo que durante a fermentação o pH muda rapidamente para 1,5-2,0, sendo pouco ácido cítrico formado até atingir esse nível. A aeração da cultura submersa deve ser continua na taxa de 0,5-1,5 v/v de solução/minuto e não pode ser interrompida, não sendo necessária agitação mecânica. Agentes anti-espumantes (livres de ferro, cobalto e níquel), devem ser adicionados para evitar perdas por excesso de espuma. Os fermentadores de aço comum devem ser revestidos, para evitar contaminação com íons metálicos.
Podem ser usadas como fontes de carboidratos soluções concentradas de xarope de cana de açúcar (30-35% de açúcar invertido), de glicose ou de sacarose (tratadas com ferrocianeto para remoção ou complexação do ferro presente no substrato).
O processo de fermentação empregado é descontínuo, sendo que a técnica de fermentação continua não são adequadas para a produção de ácido cítrico por serem muito dispendiosas e economicamente inviáveis.
Separação:
O meio filtrado deve ser submetido a outra filtração caso esteja turvo, devido a presença de anti-espumante, de micélio ou de oxalacetado. O citrato é precipitado pela adição de hidróxido de cálcio (com baixo teor de magnésio, para não formar citrato de magnésio, sendo este solúvel em agua), em seguida é filtrado e a massa transferida para um tanque, onde será tratada com acido sulfúrico para precipitar sulfato de cálcio. O sobrenadante contendo o ácido citrico é purificado por carvão ativado e desmineralizado por sucessivas passagens através de coluna com resina de troca iônica e a solução purificada é cristalizada por evaporação, sendo os cristais removidos por centrifugação. Pode ser necessária uma recristalização para atender os padrões da USP (United States Pharmacopoeia).
Em um processo de separação (patenteado pelas Usinas de Melle), o acido citrico é extraído por filtração do caldo fermentado, por solventes orgânicos, sendo posteriormente descolorido e cristalizado.
Definição
[editar | editar código-fonte]
O ácido cítrico participa do ciclo de Krebs, especificamente da segunda etapa do processo de respiração celular, sendo, por isso, presente no metabolismo de grande parte dos seres vivos. É elaborado e excretado em meio de culturas com pH próximo a 1,8 a 2,0. A degradação da glicose (via bioquímica da glicólise) produz energia e metabólitos, sendo seu produto final o ácido pirúvico, que na presença de oxigênio, é metabolizado em acetil-CoA. Existem duas vias principais para a glicólise: Monofosfato de hexose (HMP) e Embden-Meyerhof-Parnas (EMP), onde durante a fermentação de A. niger, ambas as vias são utilizadas, sendo a HMP de maior atividade durante a fase de crescimento, com pouco ácido cítrico produzido e na EMP, a maior atividade é durante a fase vegetativa, desempenhando como papel principal na glicólise, a fermentação cítrica. A acetil-CoA da via EMP reage com oxaloacetato para formar citrato. Acredita-se que a entrada desse composto no ciclo de Krebs não ocorre devido a excessiva acidez do meio.
Uma alternativa a esse método de produção é o uso de leveduras ao invés dos fungos, o que tornaria o processo economicamente mais atrativo. Porém, a maior desvantagem do uso das leveduras é a alta produção de ácido isocítrico, um produto com baixo valor comercial (ARMILIATO, 2000).
Segundo (Carmo & do Carmo n.d.), a aplicação do ácido cítrico na indústria têxtil, apesar de não ser difundida, é economicamente viável, em aspectos técnicos, ecológicos e ocupacionais, sendo a substituição do ácido acético pelo ácido cítrico ecologicamente correto, proporcionando um baixo impacto a saúde ocupacional e atende os princípios de sustentabilidade
A produção de ácido cítrico mundial ultrapassa 800.000 toneladas por ano, sendo os maiores produtores a Europa e EUA. É um mercado crescente em 4% ao ano, representando 55-65% do mercado total de acidulantes.
Industrialmente a produção se dá pelo uso de CEPAS de A. niger, porém estudasse o uso de leveduras do gênero Candida sp, por possuir maior tolerância a altas concentrações de substratos, maior taxa de conversão, maior produtividade, melhor controle do processo devido a natureza unicelular da levedura, onde também é uma alternativa para as indústrias sucroalcooleiras, sendo o maior desafio minimizar a produção simultânea de ácido isocítrico, por otimização das condições do meio de cultivo e operacionais, otimizar a tecnologia de fermentação e estudar a cinética de crescimento e produção de ácido cítrico.
Por ser um produto do metabolismo de certos organismos e um insumo para a indústria alimentícia, o ácido cítrico não oferece perigo significativo, os únicos efeitos que provoca à saúde humana é uma irritação dos olhos e da pele quando em contanto com essas regiões e intoxicação em indivíduos alérgicos. Apresenta risco químico por ser incompatível com substâncias cáusticas e oxidantes fortes.
Contextualização com a atualidade
[editar | editar código-fonte]O ácido cítrico é comercializado como anidro monohidratado e como sal sódico. Na indústria alimentícia é usado como aditivo (acidulante e antioxidante) na fabricação de refrigerantes, sobremesas, conservas de frutas, geleias, doces e vinhos. Também é utilizado na composição de sabores artificiais de refrescos em pó e na preparação de alimentos gelatinosos. Previne a turbidez, auxilia na retenção da carbonatação, potencializa os conservantes, confere sabor frutal característico, prolonga a estabilidade da vitamina C, reduz alterações de cor, realça os aromas e tampona o meio.
A Empresa Cargill do Brasil, localizada em Uberlândia/MG, é a maior produtora de ácido cítrico no país. O Brasil atualmente é autossuficiente na fabricação de ácido cítrico a partir de sacarose, adquirida do próprio estado de MG. A Cargill exporta o ácido cítrico do Brasil para todos os países latino americanos, além de países asiáticos e africanos. A produção mundial de ácido cítrico ultrapassa 800.000 toneladas/ano, sendo os maiores produtores Europa e os Estados Unidos, sendo um mercado crescente em cerca de 4%/ano (CARGILL, 2003).
Segundo (Carmo & do Carmo n.d.), a aplicação do ácido cítrico na indústria têxtil, apesar de não ser difundida, é economicamente viável, em aspectos técnicos, ecológicos e ocupacionais, sendo a substituição do ácido acético pelo ácido cítrico ecologicamente correto, proporcionando um baixo impacto a saúde ocupacional e atende os princípios de sustentabilidade.
Na indústria de conservas, o ácido cítrico de baixo pH é utilizado para reduzir o processamento térmico, e na quelação de metais traços, para evitar a oxidação enzimática e a degradação da cor. O uso do ácido cítrico como agente quelante ajuda a preservar a cor natural e impedir a descoloração de cogumelos, feijão e milho em conserva. É também utilizado para realçar o sabor.
O ácido cítrico também tem aplicação na indústria de confeitos. Os citratos controlam a inversão de açúcar, otimizam as características de fixação do gel, fornece acidez e realçam o sabor.
A produção de ácido cítrico mundial ultrapassa 800.000 toneladas por ano, sendo os maiores produtores a Europa e EUA. É um mercado crescente em 4% ao ano, representando 55-65% do mercado total de acidulantes.
Industrialmente a produção se dá pelo uso de CEPAS de A. niger, porém estuda-se o uso de leveduras do gênero Candida sp, por possuir maior tolerância a altas concentrações de substratos, maior taxa de conversão, maior produtividade, melhor controle do processo devido a natureza unicelular da levedura, onde também é uma alternativa para as indústrias sucroalcooleiras, sendo o maior desafio minimizar a produção simultânea de ácido isocítrico, por otimização das condições do meio de cultivo e operacionais, otimizar a tecnologia de fermentação e estudar a cinética de crescimento e produção de ácido cítrico.
| APLICAÇÕES DE ÁCIDO CÍTRICO | ||
|---|---|---|
| APLICAÇÕES | INDÚSTRIAS | FUNÇÕES |
| BEBIDAS | Refrigerantes e xaropes | Estimula o sabor natura da fruta. Atua como acidulante em bebidas á base de carbonato e sacarose. |
| Vinhos e cidras | Previne a turbidez de vinhos e cidras e o amarelamento de vinhos brancos. Efetua o ajuste de ph e inibe a oxidação. | |
| ALIMENTOS | Congelamento de frutas | Protege o ácido ascórbico por inativação de traços de metas. |
| Produtos lácteos | Atua como estimulante em sorvetes e no processamento de queijos e também como antioxidante. | |
| AGRICULTURA | Determina o valor de micronutrientes em fertilizantes. Aumenta a disponibilidade de fósforo nas plantas. | |
Tabela 2.0: Aplicações industriais do ácido citrico.
Referências
[editar | editar código-fonte]T.P. West, CITRIC ACID PRODUCTION BY Candida SPECIES GROWN ON A SOY-BASED CRUDE GLYCEROL, Prep Biochem Biotechnol. 43 (2013) 601–611. doi:10.1080/10826068.2012.762929.
K. Kalishwaralal, V. Deepak, S. Ram Kumar Pandian, S. Gurunathan, Biological synthesis of gold nanocubes from Bacillus licheniformis, Bioresour. Technol. 100 (2009) 5356–5358. doi:10.1016/j.biortech.2009.05.051.
ARMILIATO, L. Estudo da produção de ácido citrico por Candida lipolytica NRRL Y 1095. Universidade Estadual de Campinas, 2000.
Carmo, R.S.A. do & do Carmo, R.S.A., Ácido cítrico: um estudo sobre a viabilidade comercial e técnica de sua utilização na indústria de beneficiamento têxtil. Available at: http://dx.doi.org/10.11606/d.100.2015.tde-05052015-200502.
Soares Costa, L.M.A. et al., 2014. English. African journal of biotechnology, 13(22), pp.2220–2226.
CARGILL. Catálogo em registro eletrônico. Disponível em: <http://www.cargill.com.br/pt/index.jsp>.
Aplicações industriais do ácido citrico. Disponivel em:<http://insumos.com.br/aditivos_e_ingredientes/materias/268.pdf> Acesso em: 05 de maio de 2017.
Aplicações do ácido citrico na industria de alimentos. Disponivel em: <http://www.revista-fi.com/materias/402.pdf> Acesso em: 05 de maio de 2017.
Produção de ácido citrico por aspergillus niger: Avaliação de diferentes fontes de nitrogênio e de concentração de sacarose. Disponivel em: >http://www.uff.br/engevista/seer/index.php/engevista/article/viewFile/306/176> Acesso em: 05 de maio de 2017.
Informações técnicas ácido citrico pharma special. Disponivel em: <http://www.pharmaspecial.com.br/media/produtos/_lit_acido_citrico.pdf> Acesso em: 05 de maio de 2017.
